Trong hóa học, bazơ đóng một vai trò rất quan trọng trong nhiều phản ứng hóa học và ứng dụng trong đời sống hàng ngày. Trong bài viết này, chúng ta sẽ tìm hiểu hai bazơ quan trọng nhất: Natri hiđroxit (NaOH) và Canxi hiđroxit (Ca(OH)2). Chúng ta sẽ cùng khám phá các tính chất, ứng dụng, cũng như cách sản xuất của chúng.
A. Natri Hiđroxit (NaOH)
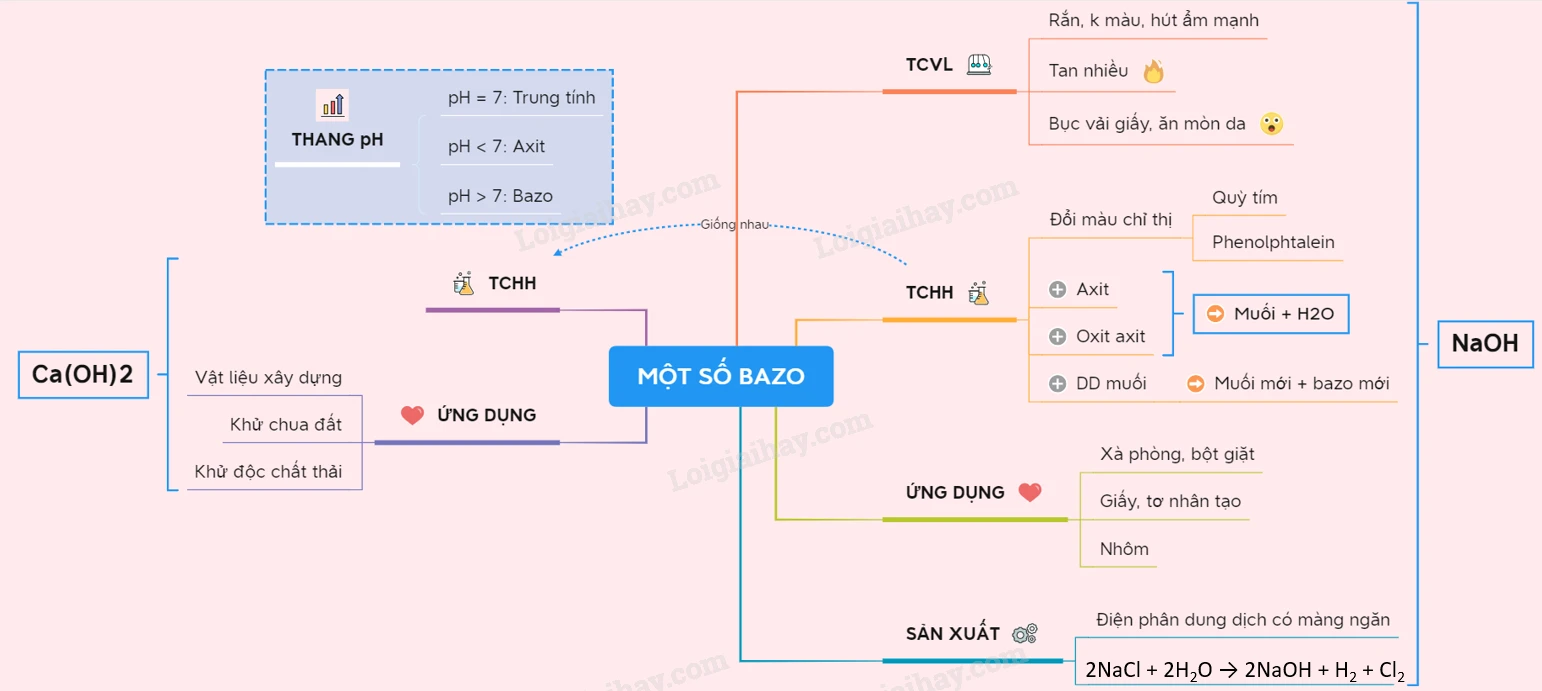
I. Tính chất vật lý
Natri hiđroxit, còn được biết đến với cái tên nước kiềm, là một chất rắn không màu, có khả năng hút ẩm mạnh mẽ. Khi hòa tan trong nước, NaOH tỏa nhiệt và tạo thành dung dịch có tính nhờn, gây ăn mòn da và làm bục các vật liệu như vải và giấy. Do vậy, việc sử dụng Natri hiđroxit đòi hỏi sự cẩn trọng cao độ.
II. Tính chất hóa học
Natri hiđroxit mang đầy đủ tính chất của một bazơ tan trong nước. Các phản ứng hóa học đặc trưng của NaOH bao gồm:
1. Làm đổi màu chất chỉ thị
- Dung dịch NaOH làm đổi màu qùy tím thành xanh.
- Dung dịch phenolphthalein chuyển từ không màu sang màu đỏ khi có mặt của NaOH.
2. Phản ứng trung hòa với axit
Khi NaOH tác dụng với axit, sẽ tạo ra muối và nước. Ví dụ:
- NaOH + HCl → NaCl + H2O
- 2NaOH + H2SO4 → Na2SO4 + H2O
3. Tác dụng với oxit axit
NaOH cũng có khả năng phản ứng với oxit axit để tạo ra muối và nước. Ví dụ:
- 2NaOH + CO2 → Na2CO3 + H2O
- 2NaOH + SO2 → Na2SO3 + H2O
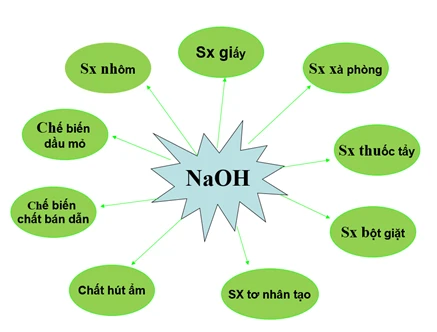
III. Ứng dụng
Natri hiđroxit được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau:
- Công nghiệp hóa chất: Dùng làm chất tẩy rửa, chất tạo độ pH, và trong sản xuất xà phòng.
- Thực phẩm: Sử dụng làm chất điều chỉnh độ acid trong chế biến thực phẩm.
- Thí nghiệm hóa học: Làm dụng cụ cho các phản ứng hóa học trong phòng thí nghiệm.
IV. Sản xuất Natri hiđroxit
Natri hiđroxit thường được sản xuất thông qua quá trình điện phân dung dịch NaCl. Phương trình điện phân được thể hiện như sau:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
Tác dụng của màng ngăn xốp là cần thiết để ngăn chặn khí clo không thoát ra và phản ứng với dung dịch NaOH. Phản ứng xảy ra như sau:
Cl2 + 2NaOH → NaCl + NaClO + H2O
---
B. Canxi Hiđroxit (Ca(OH)2)
I. Tính chất hóa học
Canxi hiđroxit là một bazơ tan, có nhiều tính chất hóa học đặc trưng:
1. Làm đổi màu chất chỉ thị
- Dung dịch Ca(OH)2 cũng làm đổi màu qùy tím thành xanh.
- Dung dịch phenolphthalein chuyển từ không màu sang màu đỏ.
2. Phản ứng trung hòa với axit
Khi Ca(OH)2 tác dụng với axit, sẽ xảy ra phản ứng tạo thành muối và nước. Ví dụ:
- Ca(OH)2 + 2HCl → CaCl2 + 2H2O
- Ca(OH)2 + H2SO4 → CaSO4 + H2O
3. Tác dụng với oxit axit
Ca(OH)2 cũng có khả năng phản ứng với oxit axit để tạo ra muối và nước. Ví dụ:
- Ca(OH)2 + CO2 → CaCO3↓ + H2O
- Ca(OH)2 + SO2 → CaSO3↓ + H2O
II. Ứng dụng
Canxi hiđroxit có nhiều ứng dụng quan trọng trong thực tế, bao gồm:
- Xây dựng: Được sử dụng làm vật liệu xây dựng, đặc biệt là trong trộn vữa và sơn.
- Nông nghiệp: Dùng để khử chua đất và cải thiện độ phì nhiêu của đất.
- Xử lý chất thải: Dùng để khử độc các chất thải công nghiệp và diệt trùng trong xử lý nước thải.
III. Thang pH
Thang pH là một thang đo quan trọng trong xác định tính chất của dung dịch:
- pH = 7: Dung dịch trung tính, ví dụ như nước cất.
- pH < 7: Dung dịch có tính acid, độ acid càng lớn khi pH càng nhỏ.
- pH > 7: Dung dịch có tính bazơ, độ bazơ càng lớn khi pH càng lớn.
Kết luận
Natri hiđroxit và Canxi hiđroxit không chỉ là những bazơ quan trọng trong hóa học mà còn có nhiều ứng dụng thiết thực trong đời sống hàng ngày. Việc hiểu rõ về tính chất, ứng dụng, và cách sản xuất của chúng là cần thiết để vận dụng hiệu quả trong các lĩnh vực khác nhau. Qua bài viết này, hy vọng bạn đã có cái nhìn tổng quan và sâu sắc hơn về hai bazơ quan trọng này.