Giới Thiệu
Oxit là những hợp chất hóa học quan trọng trong đời sống và công nghiệp. Chúng không chỉ đóng vai trò cơ bản trong nhiều phản ứng hóa học mà còn có ứng dụng rộng rãi trong các lĩnh vực khác nhau. Trong bài viết này, chúng ta sẽ tìm hiểu về hai oxit nổi bật: Canxi Oxit (CaO) và Lưu Huỳnh Đioxit (SO2).
I. Canxi Oxit (CaO)
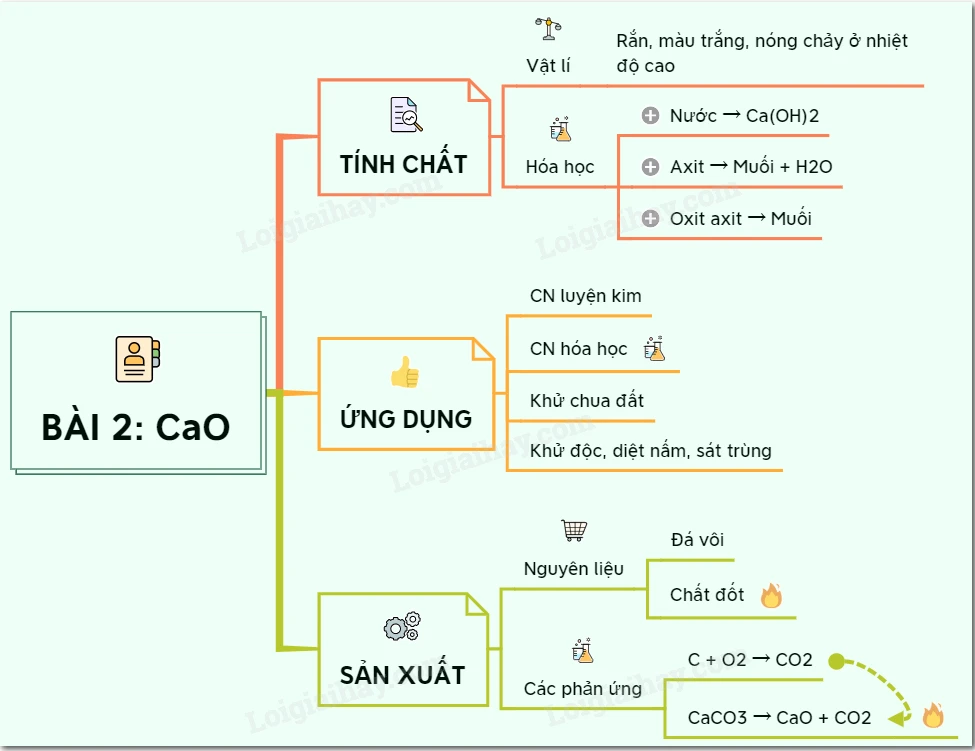
1. Tính Chất Hóa Học
Canxi Oxit, hay còn gọi là vôi sống, là một oxit bazơ với nhiều tính chất hóa học đặc trưng.
a) Tác Dụng Với Nước
Phản ứng của canxi oxit với nước là phản ứng quan trọng nhất, được gọi là phản ứng tôi vôi:
Phương trình phản ứng:
\[ \text{CaO} + \text{H}_2\text{O} \rightarrow \text{Ca(OH)}_2 \]
- Kết quả của phản ứng này là tạo ra vôi tôi (Ca(OH)2), một chất rắn màu trắng, ít tan trong nước. Phần tan sẽ tạo thành dung dịch bazơ, được gọi là nước vôi trong.
b) Tác Dụng Với Axit
Canxi oxit cũng có khả năng phản ứng với các axit, tạo thành muối và nước:
Ví dụ:
\[ \text{CaO} + 2\text{HCl} \rightarrow \text{CaCl}_2 + \text{H}_2\text{O} \]
c) Tác Dụng Với Oxit Axit
Canxi oxit có thể phản ứng với các oxit axit để tạo ra muối:
Ví dụ:
\[ \text{CaO} + \text{CO}_2 \rightarrow \text{CaCO}_3 \]
2. Ứng Dụng Của Canxi Oxit
Canxi oxit có nhiều ứng dụng trong đời sống và công nghiệp:
- Công Nghiệp Luyện Kim: Là nguyên liệu chủ yếu trong ngành luyện kim, canxi oxit được sử dụng để sản xuất các kim loại và hợp kim.
- Khử Chua Đất: Canxi oxit được dùng để cải thiện chất lượng đất trồng, giúp khử chua và tạo điều kiện thuận lợi cho cây trồng phát triển.
- Xử Lý Nước Thải: Với khả năng trung hòa axit, canxi oxit thường được áp dụng trong xử lý nước thải công nghiệp, giúp giảm thiểu ô nhiễm.
- Sát Trùng và Diệt Nấm: Canxi oxit có khả năng khử độc môi trường, diệt nấm mốc, giúp bảo vệ cây trồng và sản phẩm nông nghiệp.
- Hút Ẩm: Với tính hút ẩm mạnh mẽ, canxi oxit được sử dụng để làm khô nhiều loại chất khác nhau.
3. Sản Xuất Canxi Oxit Trong Công Nghiệp
Canxi oxit được sản xuất chủ yếu từ đá vôi (chứa CaCO3). Quá trình sản xuất diễn ra qua nhiều bước:
- Nung Đá Vôi: Đá vôi được nung ở nhiệt độ cao (trên 900°C) để phân hủy thành canxi oxit và khí carbon dioxide.
Phương trình phản ứng:
\[ \text{CaCO}_3 \xrightarrow{t^o} \text{CaO} + \text{CO}_2 \]
- Chất Đốt: Các nguyên liệu như than đá, củi, dầu, và khí tự nhiên thường được sử dụng làm chất đốt trong quá trình nung vôi.
Sơ Đồ Tư Duy: Canxi Oxit (CaO)
II. Lưu Huỳnh Đioxit (SO2)
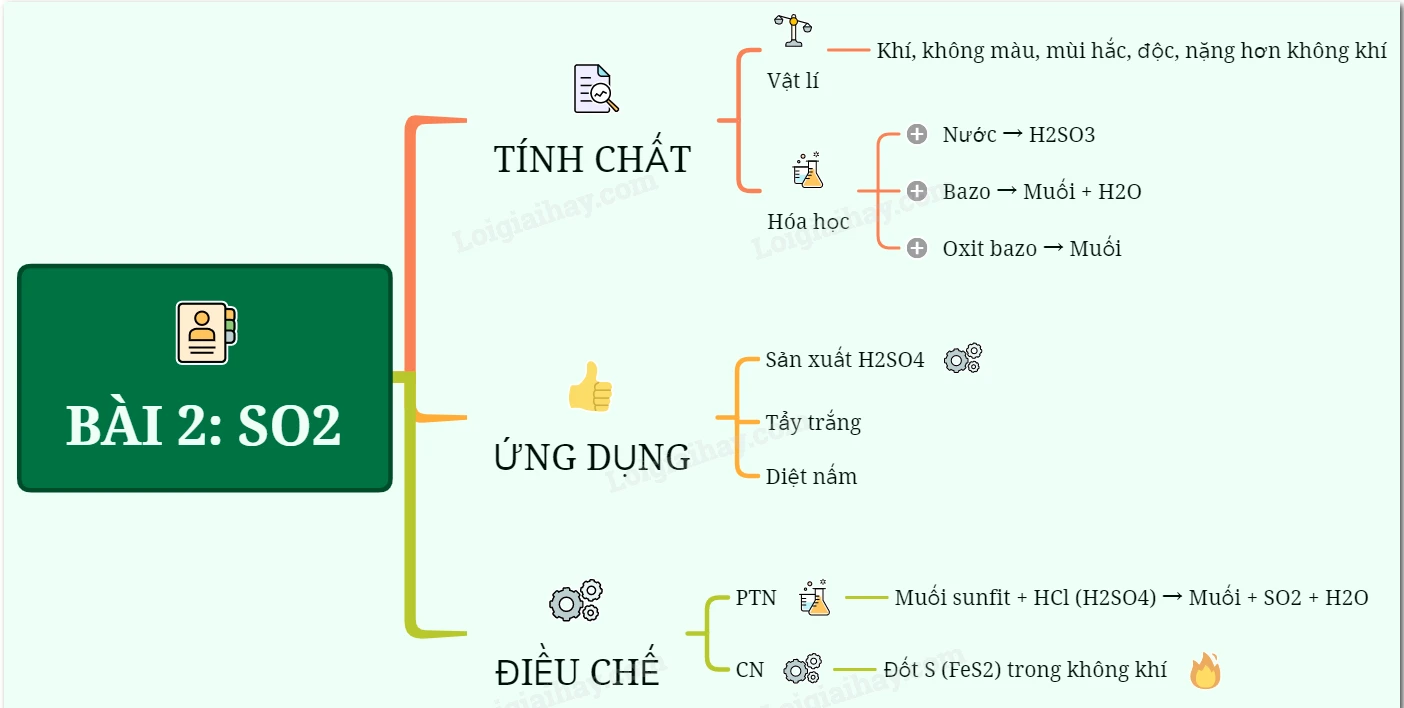
1. Tính Chất Vật Lý
Lưu huỳnh đioxit là một chất khí không màu, có mùi hắc và độc hại. Nó nặng hơn không khí, có thể gây ho và viêm đường hô hấp khi hít phải.
2. Tính Chất Hóa Học
Lưu huỳnh đioxit cũng là một oxit axit có tính chất hóa học đáng chú ý:
a) Tác Dụng Với Nước
Lưu huỳnh đioxit phản ứng với nước tạo thành axit sunfurơ:
Phương trình phản ứng:
\[ \text{SO}_2 + \text{H}_2\text{O} \rightarrow \text{H}_2\text{SO}_3 \]
- Đây cũng là một trong những nguyên nhân gây ra mưa axit, ảnh hưởng nghiêm trọng đến môi trường.
b) Tác Dụng Với Dung Dịch Bazơ
Lưu huỳnh đioxit có thể tác dụng với dung dịch bazơ để tạo thành muối và nước:
Ví dụ:
\[ \text{SO}_2 + \text{Ca(OH)}_2 \rightarrow \text{CaSO}_3 + \text{H}_2\text{O} \]
c) Tác Dụng Với Oxit Bazơ
Lưu huỳnh đioxit có khả năng phản ứng với oxit bazơ để tạo ra muối:
Ví dụ:
\[ \text{SO}_2 + \text{Na}_2\text{O} \rightarrow \text{Na}_2\text{SO}_3 \]
3. Ứng Dụng Của Lưu Huỳnh Đioxit
Lưu huỳnh đioxit có nhiều ứng dụng trong đời sống hàng ngày và trong công nghiệp:
- Sản Xuất Axit Sunfuric: Phần lớn SO2 được sử dụng để sản xuất axit sunfuric, một hóa chất quan trọng trong nhiều lĩnh vực.
- Chất Tẩy Trắng: Nó cũng được dùng làm chất tẩy trắng bột gỗ trong ngành sản xuất giấy và đường.
- Chất Diệt Nấm Mốc: Lưu huỳnh đioxit được sử dụng để diệt nấm mốc, bảo quản thực phẩm và sản phẩm nông nghiệp.
4. Điều Chế Lưu Huỳnh Đioxit
a) Trong Phòng Thí Nghiệm
Trong phòng thí nghiệm, lưu huỳnh đioxit có thể được điều chế bằng cách cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ:
\[ \text{Na}_2\text{SO}_3 + \text{H}_2\text{SO}_4 \rightarrow \text{Na}_2\text{SO}_4 + \text{SO}_2 + \text{H}_2\text{O} \]
Khí SO2 được thu bằng phương pháp đẩy không khí.
b) Trong Công Nghiệp
Trong công nghiệp, SO2 được tạo ra bằng cách đốt lưu huỳnh hoặc quặng pirit sắt trong không khí:
Ví dụ:
\[ \text{S} + \text{O}_2 \rightarrow \text{SO}_2 \]
\[ 4\text{FeS}_2 + 11\text{O}_2 \rightarrow 2\text{Fe}_2\text{O}_3 + 8\text{SO}_2 \]
Sơ Đồ Tư Duy: Lưu Huỳnh Đioxit (SO2)
Kết Luận
Canxi oxit (CaO) và lưu huỳnh đioxit (SO2) đều là những oxit quan trọng, đóng vai trò không thể thiếu trong nhiều quá trình hóa học và ứng dụng thực tiễn. Hiểu rõ về chúng không chỉ giúp ta có cái nhìn sâu sắc hơn về hóa học mà còn nhận thức được tầm quan trọng của các oxit trong đời sống hàng ngày và công nghiệp. Hy vọng bài viết này đã cung cấp thông tin hữu ích, giúp bạn hiểu thêm về một số oxit quan trọng!