1. Các Khái Niệm Về Cân Bằng Hóa Học
Cân bằng hóa học là một trong những khái niệm quan trọng trong hóa học, giúp hiểu rõ các phản ứng hóa học diễn ra trong tự nhiên. Trong phần này, chúng ta sẽ khám phá các khái niệm cơ bản liên quan đến phản ứng hóa học và cân bằng hóa học.
1.1 Phản Ứng Một Chiều
Phản ứng một chiều là phản ứng trong đó các chất phản ứng biến đổi hoàn toàn thành sản phẩm và không thể tái tạo lại các chất đầu.
Ví dụ:
Khi đốt cháy khí methane (CH4), phản ứng diễn ra như sau:
CH4 + 2O2 → CO2 + 2H2O
Ở đây, sản phẩm CO2 và H2O không thể phản ứng để tái tạo lại CH4 và O2. Phản ứng này được ký hiệu bằng một mũi tên một chiều.

1.2 Phản Ứng Thuận Nghịch
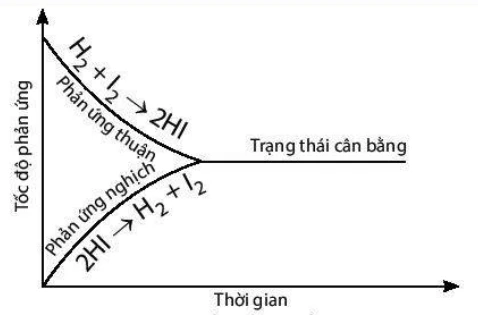
Khác với phản ứng một chiều, phản ứng thuận nghịch là phản ứng diễn ra theo cả hai chiều. Nghĩa là, ngoài việc các chất đầu phản ứng tạo ra sản phẩm, các sản phẩm cũng có thể phản ứng lại để tạo thành các chất đầu.
Ví dụ:
H2(g) + I2(g) ⇌ 2HI(g)
Tại đây, không chỉ H2 và I2 tạo thành HI, mà HI cũng có thể phân hủy trở lại thành H2 và I2. Cân bằng hóa học sẽ đạt được khi tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.

1.3 Trạng Thái Cân Bằng
Trạng thái cân bằng xảy ra khi nồng độ của các chất trong phản ứng không còn thay đổi theo thời gian, mặc dù các phản ứng vẫn diễn ra liên tục.
Ví dụ:
Trong phản ứng H2(g) + I2(g) ⇌ 2HI(g), tại thời điểm cân bằng, nồng độ của H2, I2, và HI sẽ giữ nguyên, mặc dù cả phản ứng thuận và nghịch vẫn đang diễn ra.
2. Ý Nghĩa Biểu Thức Hằng Số Cân Bằng
2.1 Biểu Thức Hằng Số Cân Bằng
Hằng số cân bằng (Kc) được định nghĩa cho phản ứng thuận nghịch như sau:
\[ K_c = \frac{[C]^c[D]^d}{[A]^a[B]^b} \]
Trong đó:
- [A], [B], [C], và [D] là nồng độ mol của các chất tương ứng ở trạng thái cân bằng.
- a, b, c, d là hệ số tỉ lượng trong phản ứng.
2.2 Ý Nghĩa Của Hằng Số Cân Bằng
Giá trị của Kc ảnh hưởng trực tiếp đến vị trí của cân bằng phản ứng. Nếu Kc lớn hơn 1, phản ứng thuận chiếm ưu thế hơn. Ngược lại, nếu Kc nhỏ hơn 1, phản ứng nghịch sẽ chiếm ưu thế.
3. Các Yếu Tố Ảnh Hưởng Đến Cân Bằng Hóa Học
3.1 Yếu Tố Nhiệt Độ
Nhiệt độ có ảnh hưởng lớn đến vị trí của cân bằng hóa học. Theo nguyên lý Le Chatelier, nếu nhiệt độ tăng đối với phản ứng tỏa nhiệt, cân bằng sẽ chuyển dịch sang hướng phản ứng nghịch.
3.2 Yếu Tố Nồng Độ
Khi nồng độ một trong các chất tham gia phản ứng tăng, cân bằng sẽ dịch chuyển để giảm bớt nồng độ của chất đó.
3.3 Yếu Tố Áp Suất
Đối với phản ứng có sự tham gia của khí, tăng áp suất sẽ dịch chuyển cân bằng về phía chứa ít mol khí hơn. Ngược lại, giảm áp suất sẽ dịch chuyển về phía có nhiều mol khí hơn.
3.4 Chất Xúc Tác
Chất xúc tác không làm thay đổi vị trí của cân bằng hóa học mà chỉ tăng tốc độ đạt được trạng thái cân bằng.
4. Câu Hỏi Trắc Nghiệm Về Cân Bằng Hóa Học
Câu 1
Cho cân bằng hóa học: 2SO2(g) + O2(g) ⇌ 2SO3(g). Phát biểu nào đúng?
A. Cân bằng sẽ chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B. Cân bằng sẽ chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
C. Cân bằng sẽ chuyển dịch theo chiều thuận khi giảm áp suất hệ.
D. Cân bằng sẽ chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
Câu 2
Cho cân bằng hóa học: N2(g) + 3H2(g) ⇌ 2NH3(g) và phản ứng thuận là tỏa nhiệt. Cân bằng sẽ không bị chuyển dịch khi:
A. thay đổi áp suất hệ.
B. thay đổi nồng độ N2.
C. thay đổi nhiệt độ.
D. thêm chất xúc tác là Fe.
---
Phần Kết Luận
Cân bằng hóa học không chỉ là một khái niệm lý thuyết mà còn là một nguyên lý quan trọng trong cả nghiên cứu và ứng dụng thực tế. Hiểu rõ về cân bằng hóa học và các yếu tố ảnh hưởng giúp chúng ta kiểm soát và tối ưu hóa các phản ứng hóa học trong công nghiệp cũng như trong nghiên cứu khoa học. Hãy tiếp tục tìm hiểu và khám phá thế giới hóa học thú vị này!